Page 51 - bingx
P. 51
Berdasarkan persamaan reaksi tersebut, dapat dijelaskan hal-hal berikut:
1. Jika persamaan reaksi dibalik, maka tanda ΔH ikut dibalik (+ jadi – atau – jadi +).
2. Jika persamaan reaksi dikalikan sejumlah x, maka ΔH pun dikalikan sejumlah x.
3. Jika persamaan reaksi dijumlahkan, maka ΔH ikut dijumlahkan.
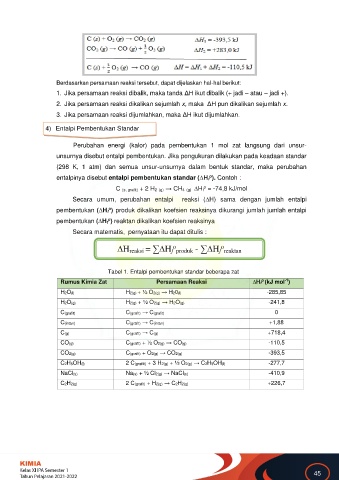
4) Entalpi Pembentukan Standar
Perubahan energi (kalor) pada pembentukan 1 mol zat langsung dari unsur-
unsurnya disebut entalpi pembentukan. Jika pengukuran dilakukan pada keadaan standar
(298 K, 1 atm) dan semua unsur-unsurnya dalam bentuk standar, maka perubahan
o
entalpinya disebut entalpi pembentukan standar (∆Hf ). Contoh :
C (s, grafit) + 2 H2 (g) → CH4 (g) ∆Hf = -74,8 kJ/mol
o
Secara umum, perubahan entalpi reaksi (∆H) sama dengan jumlah entalpi
o
pembentukan (∆Hf ) produk dikalikan koefsien reaksinya dikurangi jumlah jumlah entalpi
pembentukan (∆Hf ) reaktan dikalikan koefsien reaksinya
o
Secara matematis, pernyataan itu dapat ditulis :
o o
∆H reaksi = ∑∆H f produk - ∑∆H f reaktan
Tabel 1. Entalpi pembentukan standar beberapa zat
-1
o
Rumus Kimia Zat Persamaan Reaksi ∆Hf (kJ mol )
H2O(l) H2(g) + ½ O2(g) → H20(l) -285,85
H2O(g) H2(g) + ½ O2(g) → H2O(g) -241,8
C(grafit) C(grafit) → C(grafit) 0
C(intan) C(grafit) → C(intan) +1,88
C(g) C(grafit) → C(g) +718,4
CO(g) C(grafit) + ½ O2(g) → CO(g) -110,5
CO2(g) C(grafit) + O2(g) → CO2(g) -393,5
C2H5OH(l) 2 C(grafiit) + 3 H2(g) + ½ O2(g) → C2H5OH(l) -277,7
NaCl(s) Na(s) + ½ Cl2(g) → NaCl(s) -410,9
C2H2(g) 2 C(grafit) + H2(g) → C2H2(g) +226,7
45