Page 99 - bingx
P. 99
Pada dasarnya kekuatan gaya London dipengaruhi oleh mudah-tidaknya awan elektron dalam molekul
mengalami deformasi atau mudah tidaknya dipol sesaat dan dipol terimbas terbentuk. Ada tiga faktor
yang mempengaruhinya, yakni ukuran molekul, jumlah atom di dalam molekul dan bentuk molekul.
➢ Ukuran molekul
Molekul dengan ukuran besar mempunyai awan elektron yang besar yang mudah terdeformasi
karena elektron-elektron terluarnya cenderung tidak terikat dengan baik. Dengan demikian, dipol
sesaat dan dipol terimbas semakin mudah terbentuk. Akibatnya, gaya London akan lebih kuat
dibandingkan molekul dengan ukuran lebih kecil.
Semakin besar ukuran molekul, semakin besar kekuatan gaya London
➢ Jumlah atom di dalam molekul
Semakin banyak jumlah atom di dalam molekul, semakin banyak tempat yang tersedia untuk
terbentuknya dipol sesaat dan dipol terimbas. Dengan demikian, dipol sesaat dan dipol terimbas
semakin mudah terbentuk sehingga gaya London akan semakin kuat.
Semakin banyak jumlah atom di dalam molekul, semakin besar kekuatan gaya London
Selain gaya dipol-dipol, dalam molekul polar juga terdapat gaya dispersi/gaya London. Jika
membandingkan molekul yang massa molekulnya berbeda jauh, gaya london bisa lebih dominan.
Sementara itu, jika massa molekulnya relatif sama, maka gaya dipol-dipol memberikan pengaruh
perbedaan yang signifikan terhadap titik didih. Pada HCl dan HBr jika dimisalkan kedua senyawa
tersebut hanya memiliki gaya dipol-dipol, maka titik didih HCl>HBr karena HCl memiliki momen dipol
yang besar daripada HBr. Tetapi secara eksperimen menunjukkan bahwa titik didih HBr>HCl. Hal ini
menunjukkan bahwa ada gaya lain yang bekerja pada antarmolekul itu. Gaya yang lain ini berhubungan
dengan banyaknya elektron yang ada pada molekul itu. Gaya yang berhubungan dengan jumlah
elektron atau massa molekul suatu zat adalah gaya London. Jadi dalam molekul-molekul yang bersifat
polar, selain terjadi gaya dipol-dipol juga terjadi gaya London. Begitu pula molekul polar dengan molekul
nonpolar, selain terjadi gaya dipol-dipol induksian juga terjadi gaya London.
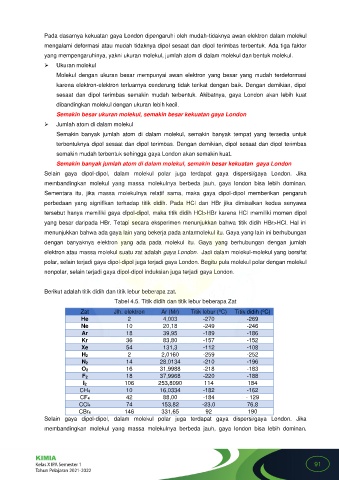
Berikut adalah titik didih dan titik lebur beberapa zat.
Tabel 4.5. Titik didih dan titik lebur beberapa Zat
Zat Jlh. elektron Ar (Mr) Titik lebur ( C) Titik didih ( C)
o
o
He 2 4,003 -270 -269
Ne 10 20,18 -249 -246
Ar 18 39,95 -189 -186
Kr 36 83,80 -157 -152
Xe 54 131,3 -112 -108
H 2 2 2,0160 -259 -252
N 2 14 28,0134 -210 -196
O 2 16 31,9988 -218 -183
F 2 18 37,9968 -220 -188
I 2 106 253,8090 114 184
CH4 10 16,0334 -182 -162
CF4 42 88,00 -184 - 129
CCl4 74 153,82 -23,0 76,8
CBr4 146 331,65 92 190
Selain gaya dipol-dipol, dalam molekul polar juga terdapat gaya dispersi/gaya London. Jika
membandingkan molekul yang massa molekulnya berbeda jauh, gaya london bisa lebih dominan.
91