Page 74 - MODUL KIMIA GABUNGAN KELAS XII SEM 1-EDIT JUNI 2021 - EDIT TIM
P. 74
Kuatnya gaya tarik antar molekul yang terjadi pada golongan gas
Sekilas Balik ☺
mulia (dari atas ke bawah) tidak hanya mempengaruhi bertambahnya
kerapatan gas mulia, tetapi juga mempengaruhi bertambahnya titik didih,
Gaya tarik antar molekul titik leleh.
Kuatnya gaya tarik menarik antar molekul (gaya London) pada gas
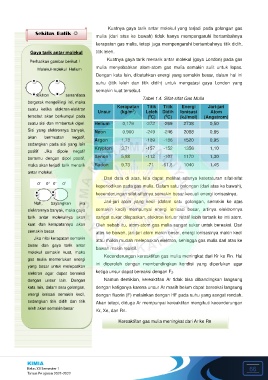
Perhatikan gambar berikut !
mulia menyebabkan atom-atom gas mulia semakin sulit untuk lepas.
Molekul-molekul Helium
Dengan kata lain, dibutuhkan energi yang semakin besar, dalam hal ini
suhu (titik leleh dan titik didih) untuk mengatasi gaya London yang
semakin kuat tersebut.
Elektron senantiasa
Tabel 1.4. Sifat-sifat Gas Mulia
bergerak mengelilingi inti, maka
Kerapatan Titik Titik Energi Jari-jari
suatu ketika elektron-elektron
3
Unsur (kg/m ) Leleh Didih Ionisasi Atom
tersebut akan berkumpul pada ( C) ( C) (kJ/mol) (Angstrom)
0
0
suatu sisi dan mmbentuk dipol. Helium 0,179 -272 -269 2738 0,50
Sisi yang elektronnya banyak, Neon 0,900 -249 -246 2088 0,65
akan bermuatan negatif,
Argon 1,78 -189 -186 1520 0,95
sedangkan pada sisi yang lain
Krypton 3,71 -157 -152 1356 1,10
positif. Jika dipole negatif
Xenon 5,88 -112 -107 1170 1,30
bertemu dengan dipol positif,
maka akan terjadi tarik menarik Radon 9,73 -71 -61,8 1040 1,45
antar molekul.
Dari data di atas, kita dapat melihat adanya keteraturan sifat-sifat
- + - +
σ σ σ
σ
keperiodikan pada gas mulia. Dalam satu golongan (dari atas ke bawah),
kecenderungan sifat-sifatnya semakin besar kecuali energi ionisasinya.
Nah, bayangkan jika Jari-jari atom yang kecil (dalam satu golongan, semakin ke atas
elektronnya banyak, maka gaya semakin kecil) mempunyai energi ionisasi besar, artinya elektronnya
tarik antar molekulnya akan sangat sukar dilepaskan, elektron terluar relatif lebih tertarik ke inti atom.
kuat dan kerapatannya akan Oleh sebab itu, atom-atom gas mulia sangat sukar untuk bereaksi. Dari
semakin besar. atas ke bawah, jari-jari atom makin besar, energi ionisasinya makin kecil
Jika nilai kerapatan semakin
atau makin mudah melepaskan elektron, sehingga gas mulia dari atas ke
besar dan gaya tarik antar
bawah makin reaktif.
molekul semakin kuat, maka
Kecenderungan kereaktifan gas mulia meningkat dari Kr ke Rn. Hal
gas mulia memerlukan energi
ini diperoleh dengan membandingkan kondisi yang diperlukan agar
yang besar untuk melepaskan
elektron agar dapat bereaksi ketiga unsur dapat bereaksi dengan F2.
dengan unsur lain. Dengan Namun demikian, kereaktifan Ar tidak bisa dibandingkan langsung
kata lain, dalam satu golongan, dengan ketiganya karena unsur Ar masih belum dapat bereaksi langsung
energi ionisasi semakin kecil, dengan fluorin (F) melainkan dengan HF pada suhu yang sangat rendah.
sedangkan titik didih dan titik Akan tetapi, diduga Ar mempunyai kereaktifan mengikuti kecenderungan
leleh akan semakin besar
Kr, Xe, dan Rn.
Kereaktifan gas mulia meningkat dari Ar ke Rn
66