Page 65 - MODUL KIMIA GABUNGAN KELAS XII SEM 1-EDIT JUNI 2021 - EDIT TIM
P. 65
tinggi keelektronegatifan maka semakin reaktif unsur halogen karena semakin mudah menarik
elektron.
(3). Pengoksidasi
Halogen merupakan oksidator (pengoksidasi) kuat. Unsur-unsur halogen mudah mengikat
elektron sehingga halogen mudah tereduksi. Dari flourin sampai iodin sifat
oksidator/pengoksidasi halogen semakin berkurang.
c) Sifat Atomik Halogen
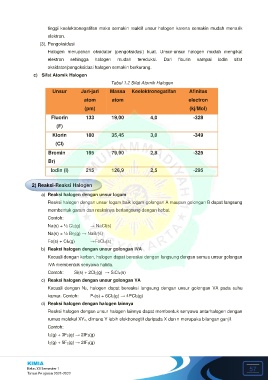
Tabel 1.2 Sifat Atomik Halogen
Unsur Jari-jari Massa Keelektronegatifan Afinitas
atom atom electron
(pm) (kj/Mol)
Fluorin 133 19,00 4,0 -328
(F)
Klorin 180 35,45 3,0 -349
(Cl)
Bromin 195 79,90 2,8 -325
Br)
Iodin (I) 215 126,9 2,5 -295
2) Reaksi-Reaksi Halogen
a) Reaksi halogen dengan unsur logam
Reaksi halogen dengan unsur logam,baik logam golongan A maupun golongan B dapat langsung
membentuk garam dan reaksinya berlangsung dengan hebat.
Contoh:
Na(s) + ½ Cl2(g) → NaCl(s)
Na(s) + ½ Br2(g) → NaBr(s)
Fe(s) + Cl2(g) →FeCl2(s)
b) Reaksi halogen dengan unsur golongan IVA
Kecuali dengan karbon, halogen dapat bereaksi dengan langsung dengan semua unsur golongan
IVA membentuk senyawa halida.
Contoh: Si(s) + 2Cl2(g) → SiCl4(s)
c) Reaksi halogen dengan unsur golongan VA
Kecuali dengan N2, halogen dapat bereaksi langsung dengan unsur golongan VA pada suhu
kamar. Contoh: P4(s) + 6Cl2(g) → 4PCl3(g)
d) Reaksi halogen dengan halogen lainnya
Reaksi halogen dengan unsur halogen lainnya dapat membentuk senyawa antarhalogen dengan
rumus molekul XYn, dimana Y lebih elektronegtif daripada X dan n merupaka bilangan ganjil.
Contoh:
I2(g) + 3F2(g) → 2IF3(g)
I2(g) + 5F2(g) → 2IF5(g)
57