Page 106 - MODUL KIMIA GABUNGAN KELAS XII SEM 1-EDIT JUNI 2021 - EDIT TIM
P. 106
Energi ionisasi
Energi ionisasi adalah energi yang diperlukan untuk
melepaskan elektron yang tidak terikat dengan erat dari atom
dalam bentuk gas. Kecenderungan energi ionisasi unsur-unsur
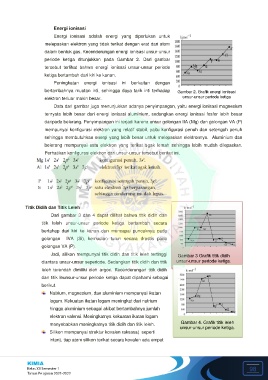
periode ketiga ditunjukkan pada Gambar 2. Dari gambar
tersebut terlihat bahwa energi ionisasi unsur-unsur periode
ketiga bertambah dari kiri ke kanan.
Peningkatan energi ionisasi ini berkaitan dengan
bertambahnya muatan inti, sehingga daya tarik inti terhadap Gambar 2. Grafik energi ionisasi
elektron terluar makin besar. unsur-unsur periode ketiga
Data dari gambar juga menunjukkan adanya penyimpangan, yaitu energi ionisasi magnesium
ternyata lebih besar dari energi ionisasi aluminium, sedangkan energi ionisasi fosfor lebih besar
daripada belerang. Penyimpangan ini terjadi karena unsur golongan IIA (Mg) dan golongan VA (P)
mempunyai konfigurasi elektron yang relatif stabil, yaitu konfigurasi penuh dan setengah penuh
sehingga membutuhkan energi yang lebih besar untuk melepaskan elektronnya. Aluminium dan
belerang mempunyai satu elektron yang terikat agak lemah sehingga lebih mudah dilepaskan.
Perhatikan konfigurasi elektron dari unsur-unsur tersebut berikut ini.
Titik Didih dan Titik Leleh
Dari gambar 3 dan 4 dapat dilihat bahwa titik didih dan
titik leleh unsur-unsur periode ketiga bertambah secara
bertahap dari kiri ke kanan dan mencapai puncaknya pada
golongan IVA (Si), kemudian turun secara drastis pada
golongan VA (P).
Jadi, silikon mempunyai titik didih dan titik leleh tertinggi Gambar 3 Grafik titik didih
diantara unsur-unsur seperiode. Sedangkan titik didih dan titik unsur-unsur periode ketiga.
leleh terendah dimiliki oleh argon. Kecenderungan titik didih
dan titik leunsur-unsur periode ketiga dapat dipahami sebagai
berikut.
Natrium, magnesium, dan aluminium mempunyai ikatan
logam. Kekuatan ikatan logam meningkat dari natrium
hingga aluminium sebagai akibat bertambahnya jumlah
elektron valensi. Meningkatnya kekuatan ikatan logam
menyebabkan meningkatnya titik didih dan titik leleh. Gambar 4. Grafik titik leleh
unsur-unsur periode ketiga.
Silikon mempunyai struktur kovalen raksasa( seperti
intan), tiap atom silikon terikat secara kovalen ada empat
98