Page 105 - MODUL KIMIA GABUNGAN KELAS XII SEM 1-EDIT JUNI 2021 - EDIT TIM
P. 105
d) Belerang
Belerang ditemukan di alam sebagai unsur bebas, sulfat maupun sebagai bijih sulfida.
Sebagai unsur bebas biasanya ditemukan dalam lapisan ± 150 m di bawah batu karang, pasir, atau
tanah liat di daerah gunung berapi. Dalam bentuk unsur bebas, belerang banyak terdapat di dekat
kawah gunung berapi dan ada sebagian yang berada di dalam tanah. Di indonesia, unsur belerang
banyak ditemukan di daerah Dieng.
Sulfida banyak ditemui di daerah pegunungan, dalam bentuk blende (tidak mengkilap),
glans (mengkilap dan berwarna gelap) serta kies (mengkilap dan berwarna muda). Misal timbal
glan/galena (PbS), seng blende (ZnS), dan pirit (FeS2). Sebagai senyawa sulfat, belerang
ditemukan dalam batu tahu atau gips anhidrit (CaSO4), barium sulfat (BaSO4), dan magnesium sulfat
(MgSO4). Selain ditemukan dalam keadaan bebas dan sebagai sulfida dan sulfat belerang dapat
juag ditemukan dalam hewan sebagai penyusun putih telur dan tanah pertanian.
2). Sifat-Sifat Unsur Periode Ketiga
1 Sifat Fisika
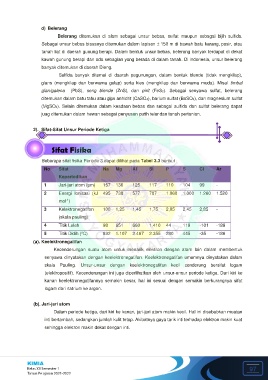
Beberapa sifat fisika Periode 3 dapat dilihat pada Tabel 3.3 berikut :
No Sifat Na Mg Al Si P S Cl Ar
Keperiodikan
1 Jari-jari atom (pm) 157 136 125 117 110 104 99 -
2 Energi Ionisasi (kJ 495 738 577 787 1.060 1.000 1.260 1.520
-1
mol )
3 Kelektronegatifan 100 1,25 1,45 1,75 2,05 2,45 2,85 -
(skala pauling)
4 Titik Leleh 98 651 660 1.410 44 119 -101 -189
o
5 Titik Didih ( C) 892 1.107 2.467 2.355 280 445 -35 -186
(a). Keelektronegatifan
Kecenderungan suatu atom untuk menarik elektron dengan atom lain dalam membentuk
senyawa dinyatakan dengan keelektronegatifan. Keelektronegatifan umumnya dinyatakan dalam
skala Pauling. Unsur-unsur dengan keelektronegatifan kecil cenderung bersifat logam
(elektropositif). Kecenderungan ini juga diperlihatkan oleh unsur-unsur periode ketiga. Dari kiri ke
kanan keelektronegatifannya semakin besar, hal ini sesuai dengan semakin berkurangnya sifat
logam dari natrium ke argon.
(b). Jari-jari atom
Dalam periode ketiga, dari kiri ke kanan, jari-jari atom makin kecil. Hal ini disebabkan muatan
inti bertambah, sedangkan jumlah kulit tetap. Akibatnya gaya tarik inti terhadap elektron makin kuat
sehingga elektron makin dekat dengan inti.
97