Page 11 - MODUL KIMIA GABUNGAN KELAS XII SEM 1-EDIT JUNI 2021 - EDIT TIM
P. 11
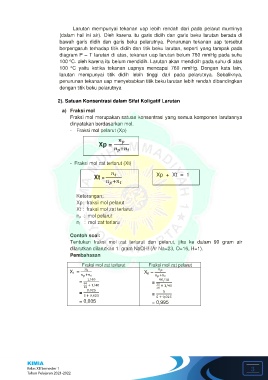
Larutan mempunyai tekanan uap lebih rendah dari pada pelarut murninya
(dalam hal ini air). Oleh karena itu garis didih dan garis beku larutan berada di
bawah garis didih dan garis beku pelarutnya. Penurunan tekanan uap tersebut
berpengaruh terhadap titik didih dan titik beku larutan, seperti yang tampak pada
diagram P – T larutan di atas, tekanan uap larutan belum 760 mmHg pada suhu
o
100 C. oleh karena itu belum mendidih. Larutan akan mendidih pada suhu di atas
100 C yaitu ketika tekanan uapnya mencapai 760 mmHg. Dengan kata lain,
o
larutan mempunyai titik didih lebih tinggi dari pada pelarutnya. Sebaliknya,
penurunan tekanan uap menyebabkan titik beku larutan lebih rendah dibandingkan
dengan titik beku pelarutnya
2). Satuan Konsentrasi dalam Sifat Koligatif Larutan
a) Fraksi mol
Fraksi mol merupakan satuan konsentrasi yang semua komponen larutannya
dinyatakan berdasarkan mol.
- Fraksi mol pelarut (Xp)
Xp =
+
- Fraksi mol zat terlarut (Xt)
Xt = Xp + Xt = 1
+
Keterangan;
Xp: fraksi mol pelarut
Xt : fraksi mol zat terlarut
np : mol pelarut
nt : mol zat terlaru
Contoh soal:
Tentukan fraksi mol zat terlarut dan pelarut, jika ke dalam 90 gram air
dilarutkan dilarutkan 1 gram NaOH! (Ar Na=23, O=16, H=1).
Pembahasan
Fraksi mol zat terlarut Fraksi mol zat pelarut
Xt = Xp =
+ +
= 90 1/40 = 90 90/18
18 + 1/40 18 + 1/40
= 0,025 = 5
5 + 0,025 5 + 0,025
= 0,005 = 0,995
3