Page 80 - bingx
P. 80
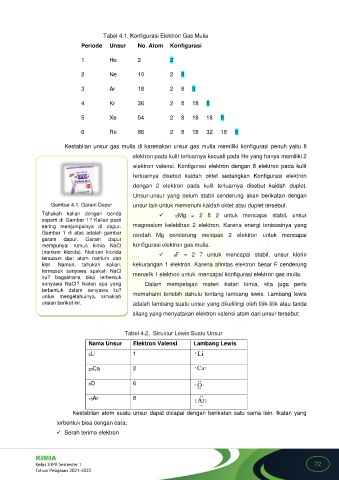
Tabel 4.1. Konfigurasi Elektron Gas Mulia
Periode Unsur No. Atom Konfigurasi
1 He 2 2
2 Ne 10 2 8
3 Ar 18 2 8 8
4 Kr 36 2 8 18 8
5 Xe 54 2 8 18 18 8
6 Rn 86 2 8 18 32 18 8
Kestabilan unsur gas mulia di karenakan unsur gas mulia memiliki konfigurasi penuh yaitu 8
elektron pada kulit terluarnya kecuali pada He yang hanya memiliki 2
elektron valensi. Konfigurasi elektron dengan 8 elektron pada kulit
terluarnya disebut kaidah oktet sedangkan Konfigurasi elektron
dengan 2 elektron pada kulit terluarnya disebut kaidah duplet.
Unsur-unsur yang belum stabil cenderung akan berikatan dengan
Gambar 4.1. Garam Dapur unsur lain untuk memenuhi kaidah oktet atau duplet tersebut.
Tahukah kalian dengan benda ✓ 12Mg = 2 8 2 untuk mencapai stabil, unsur
seperti di Gambar 1? Kalian pasti
sering menjumpainya di dapur. magnesium kelebihan 2 elektron. Karena energi ionisasinya yang
Gambar 1 di atas adalah gambar rendah Mg cenderung melepas 2 elektron untuk mencapai
garam dapur. Garam dapur
mempunyai rumus kimia NaCl konfigurasi elektron gas mulia.
(natrium klorida). Natrium klorida ✓ 9F = 2 7 untuk mencapai stabil, unsur klorin
tersusun dari atom natrium dan
klor. Namun, tahukah kalian, kekurangan 1 elektron. Karena afinitas elektron besar F cenderung
termasuk senyawa apakah NaCl menarik 1 elektron untuk mencapai konfigurasi elektron gas mulia.
itu? bagaimana bisa terbentuk
senyawa NaCl? Ikatan apa yang Dalam mempelajari materi ikatan kimia, kita juga perlu
terbentuk dalam senyawa itu?
untuk mengetahuinya, simaklah memahami terlebih dahulu tentang lambang lewis. Lambang lewis
uraian berikut ini. adalah lambang suatu unsur yang dikelilingi oleh titik-titik atau tanda
silang yang menyatakan elektron valensi atom dari unsur tersebut.
Tabel 4.2. Struktur Lewis Suatu Unsur
Nama Unsur Elektron Valensi Lambang Lewis
3Li 1
20Ca 2
8O 6
18Ar 8
Kestabilan atom suatu unsur dapat dicapai dengan berikatan satu sama lain. Ikatan yang
terbentuk bisa dengan cara:
✓ Serah terima elektron
72