Page 75 - bingx
P. 75
elektronnya berharga negatif. Jika harga afinitas elektron makin negatif, berarti afinitas elektron
semakin besar. Perhatikan tabel afinitas elektron berikut ini.
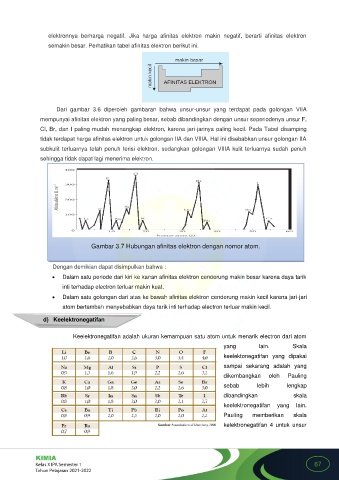
Dari gambar 3.6 diperoleh gambaran bahwa unsur-unsur yang terdapat pada golongan VIIA
mempunyai afinitas elektron yang paling besar, sebab dibandingkan dengan unsur seperiodenya unsur F,
Cl, Br, dan I paling mudah menangkap elektron, karena jari-jarinya paling kecil. Pada Tabel disamping
tidak terdapat harga afinitas elektron untuk golongan IIA dan VIIIA. Hal ini disebabkan unsur golongan IIA
subkulit terluarnya telah penuh terisi elektron, sedangkan golongan VIIIA kulit terluarnya sudah penuh
sehingga tidak dapat lagi menerima elektron.
Gambar 3.7 Hubungan afinitas elektron dengan nomor atom.
Dengan demikian dapat disimpulkan bahwa :
• Dalam satu periode dari kiri ke kanan afinitas elektron cenderung makin besar karena daya tarik
inti terhadap electron terluar makin kuat.
• Dalam satu golongan dari atas ke bawah afinitas elektron cenderung makin kecil karena jari-jari
atom bertambah menyebabkan daya tarik inti terhadap electron terluar makin kecil.
d) Keelektronegatifan
Keelektronegatifan adalah ukuran kemampuan satu atom untuk menarik electron dari atom
yang lain. Skala
keelektonegatifan yang dipakai
sampai sekarang adalah yang
dikembangkan oleh Pauling
sebab lebih lengkap
dibandingkan skala
keelektronegatifan yang lain.
Pauling memberikan skala
kelektronegatifan 4 untuk unsur
67