Page 122 - MODUL KIMIA GABUNGAN KELAS XII SEM 1-EDIT JUNI 2021 - EDIT TIM
P. 122
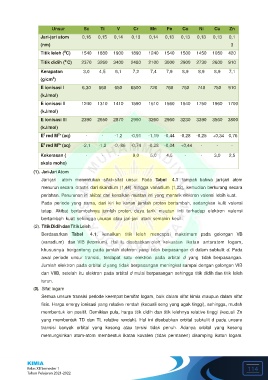
Unsur Sc Ti V Cr Mn Fe Co Ni Cu Zn
Jari-jari atom 0,16 0,15 0,14 0,13 0,14 0,13 0,13 0,13 0,13 0,1
(nm) 3
0
Titik leleh ( C) 1540 1680 1900 1890 1240 1540 1500 1450 1080 420
0
Titik didih ( C) 2370 3260 3400 2480 2100 3000 2900 2730 2600 910
Kerapatan 3,0 4,5 6,1 7,2 7,4 7,9 8,9 8,9 8,9 7,1
3
(g/cm )
E ionisasi I 6,30 660 650 6500 720 760 760 740 750 910
(kJ/mol)
E ionisasi II 1240 1310 1410 1590 1510 1560 1640 1750 1960 1700
(kJ/mol)
E ionisasi III 2390 2650 2870 2990 3260 2960 3230 3390 3560 3800
(kJ/mol)
0
2+
E red M (aq) - - -1,2 -0,91 -1,19 -0,44 -0,28 -0,25 +0,34 0,76
3+
0
E red M (aq) -2,1 -1,2 -0,-86 -0,74 -0,28 -0,04 +0,44 - - -
Kekerasan ( - - - 9,0 5,0 4,5 - - 3,0 2,5
skala mohs)
(1). Jari-Jari Atom
Jari-jari atom menentukan sifat-sifat unsur. Pada Tabel 4.1 tampak bahwa jari-jari atom
menurun secara drastis dari skandium (1,44) hingga vanadium (1,22), kemudian berkurang secara
perlahan. Penurunan ini akibat dari kenaikan muatan inti yang menarik elektron valensi lebih kuat.
Pada periode yang sama, dari kiri ke kanan jumlah proton bertambah, sedangkan kulit valensi
tetap. Akibat bertambahnya jumlah proton, daya tarik muatan inti terhadap elektron valensi
bertambah kuat sehingga ukuran atau jari-jari atom semakin kecil.
(2). Titik Didih dan Titik Leleh
Berdasarkan Tabel 4.1, kenaikan titik leleh mencapai maksimum pada golongan VB
(vanadium) dan VIB (kromium). Hal itu disebabkan oleh kekuatan ikatan antaratom logam,
khususnya bergantung pada jumlah elektron yang tidak berpasangan di dalam subkulit d. Pada
awal periode unsur transisi, terdapat satu elektron pada orbital d yang tidak berpasangan.
Jumlah elektron pada orbital d yang tidak berpasangan meningkat sampai dengan golongan VIB
dan VIIB, setelah itu elektron pada orbital d mulai berpasangan sehingga titik didih dan titik leleh
turun.
(3). Sifat logam
Semua unsure transisi periode keempat bersifat logam, baik dalam sifat kimia maupun dalam sifat
fisis. Harga energy ionisasi yang relative rendah (kecuali seng yang agak tinggi), sehingga, mudah
membentuk ion positif. Demikian pula, harga titik didih dan titik lelehnya relative tinggi (kecuali Zn
yang membentuk TD dan TL relative rendah). Hal ini disebabkan orbital subkulit d pada unsure
transisi banyak orbital yang kosong atau tersisi tidak penuh. Adanya orbital yang kosong
memungkinkan atom-atom membentuk ikatan kovalen (tidak permanen) disamping ikatan logam.
114